Редкие хирургические заболевания желудка — одна из наименее изученных проблем абдоминальной хирургии. Они относятся к редким заболеваниям в целом. Одним из первых законодательных актов по редким заболеваниям был «Закон об орфанных препаратах» (Orphan Drug Act (ODA)), принятый в январе 1983 г. в США под влиянием Национального комитета по редким заболеваниям (National Organization for Rare Disorders), который давал существенные налоговые послабления фармацевтическим компаниям, разрабатывающим лекарственные препараты для лечения редких заболеваний. И если с 1973 по 1983 гг. на рынок было выпущено всего 10 препаратов для лечения редких заболеваний, то за последующие 20 лет это количество увеличилось до 249 наименований.
«Orphan» — переводится с английского как «сирота». Сиротскими называют препараты, предназначенные для лечения пациентов с редкими заболеваниями. Это определение в полной мере отражает отношение общества к данной проблематике.
В последующем в законодательстве США был принят акт о редких заболеваниях («Rare Disease Act» (2002)), который определяет редкие болезни, как «болезни или состояния, затрагивающие менее 200 000 людей в США». В Японии редкие болезни определяются, как болезни, затрагивающие менее 50 000 пациентов или встречающиеся с частотой 1 : 2500 населения.
Общепринято считать редкими болезнями при уровне распространения от 1 : 1000 до 1 : 200 000 населения.
По данным Европейского общества по редким заболеваниям (EURORDIS) существует порядка 5000–7000 различных редких заболеваний. Кроме того, по данным того же общества редкими болезнями страдает 6–8 % жителей Евросоюза. И если экстраполировать существующие данные на Российскую Федерацию, то редкими заболеваниями в нашей стране страдает порядка 5,0–5,5 млн человек.
С 2008 г. по инициативе EURORDIS последний день февраля объявлен днем редких заболеваний (Rare Disease Day).
КЛАССИФИКАЦИЯ РЕДКИХ ХИРУРГИЧЕСКИХ ЗАБОЛЕВАНИЙ ЖЕЛУДКА
Классификации редких хирургических заболеваний желудка в настоящее время нет. Для структурирования имеющегося многообразия нами предложена рабочая классификация редких хирургических заболеваний желудка, которая позволяет упорядочить и выделить в отдельные группы различные болезни, учитывая при этом этиологические и патогенетические аспекты заболеваний.
Целесообразно выделить две основные группы, разделив при этом все редкие хирургические заболевания на врожденные и приобретенные.
Врожденные заболевания:
особенности анатомии;
аномалии развития;
генетически детерминированные.
Приобретенные заболевания:
инфекционно-воспалительного характера;
опухолевого характера;
экзогенного характера.
В табл. 1 представлена более расширенная классификация редких хирургических заболеваний желудка.
Таблица 1

ВРОЖДЕННЫЕ ЗАБОЛЕВАНИЯ
Врожденные заболевания: Особенности анатомии
ОСТРОЕ РАСШИРЕНИЕ ЖЕЛУДКА
Впервые в медицинской литературе острое расширение желудка было описано в 1889 г. Н. С. Засядько. Возникает оно, как правило, на фоне обильного приема пищи, и в частности в послеоперационном периоде. Сопровождается острым нарушением желудочной моторики по атоничному типу. При этом желудок резко расширяется и смещается книзу с натяжением брыжейки тонкой кишки и сдавлением мезентериальными сосудами нижней горизонтальной части двенадцатиперстной кишки, вызывая тем самым острую «артериомезентериальную непроходимость» с соответствующей клинической картиной.
В литературе выделяют первичное и вторичное острое расширение. Основным механизмом в развитии острого расширения желудка является паралич нервно-мышечного аппарата стенки желудка в результате угнетения блуждающих нервов.
Первичное острое расширение желудка, как правило, возникает у лиц, склонных к перееданию. Вторичное — чаще всего наблюдается в послеоперационном периоде, реже при заболеваниях нервной и эндокринной систем, стенозе привратника, инфаркте миокарда, тяжелых инфекциях, а также при приеме обильной пищи, богатой клетчаткой.
Клиническая картина проявляется упорной обильной рвотой до 6–8 л в сутки с последующими водно-электролитными нарушениями. Живот резко увеличивается в эпигастрии, где определяется шум плеска. Некупирующееся расширение желудка ведет к олигурии, гипокалиемии, гипохлоремии, алкалозу и далее к желудочной тетании. Одним из самых грозных осложнений при острых расширениях желудка является разрыв задней стенки, чаще кардиальной части желудка.
Лечение преимущественно консервативное, основным компонентом которого является установка зонда в желудок и эффективная эвакуация содержимого. При развитии осложнений показано оперативное лечение — ушивание дефекта желудка.
Врожденные заболевания: Особенности анатомии
ЗАВОРОТ ЖЕЛУДКА
Термин «заворот» происходит от латинского слова volvere и переводится как «повернуться» или «катиться». Впервые заворот желудка был описан в 1866 г. А. Berthi, который выявил его при вскрытии трупа 60-летней женщины. В 1897 г. J. Berg сообщил о первой успешной операции, выполненной при завороте желудка. В отечественной литературе первое наблюдение заворота желудка принадлежит Ф. Г. Цейдлеру (1902).
Заворот желудка — редкое хирургическое заболевание. В мировой литературе к началу 80-х годов прошлого столетия было описано около 500 наблюдений, а к 2006 г. описано уже более 700 наблюдений заворота желудка.
Заболевание может встречаться в любом возрасте, однако чаще наблюдается у людей в возрасте 40–50 лет и у детей грудного возраста (20%).
При развитии заворота желудка можно выделить два основных фактора: предрасполагающий и производящий.
К предрасполагающим факторам относят: гастроптоз, деформацию желудка вследствие перигастрита, язвенной болезни, диафрагмальной грыжи, релаксации диафрагмы, «слабости» связочного аппарата желудка.
Желудок является мобильным органом в физиологических условиях, особенно в период пищеварения, когда желудок совершает ротации вокруг продольной и поперечной осей без болевых ощущений. Однако при «слабости» связочного аппарата желудка создаются благоприятные условия для возникновения его патологической подвижности и развития заворота. Подтверждением этого положения являются экспериментальные исследования на трупах, выполненные J. Dalgaard (1952), установившим, что поворот желудка на 180° и более невозможен, если желудочно-ободочная или желудочно-селезеночная связки либо они обе не рассечены.
Растяжение и удлинение связочного аппарата желудка является одним из факторов, предрасполагающих к возникновению заворота желудка. Описано развитие заворота желудка у больных с врожденным отсутствием желудочно-толстокишечной связки, патологической подвижностью двенадцатиперстной кишки и селезенки.
Кроме связочного аппарата желудка, важная роль среди предрасполагающих факторов заворота желудка принадлежит таким патологическим состояниям диафрагмы, как релаксация и диафрагмальные грыжи (параэзофагеальная грыжа, скользящая грыжа пищеводного отверстия диафрагмы, реже грыжи Бохдалека, Ларрея–Морганьи, травматические грыжи). У детей релаксация левого купола диафрагмы и врожденные дефекты ее развития встречаются более чем в 50% наблюдений заворота желудка. Кроме того, у детей наблюдали сочетание заворота желудка с другими аномалиями развития: врожденным пилоростенозом, агенезией легкого или одной доли печени, атрезией прямой кишки. Описаны случаи возникновения заворота желудка после некоторых оперативных вмешательств: гастростомии, селективной ваготомии, фундопликации по Ниссену, операции Льюиса.
Производящими факторами являются: повышение внутрибрюшного давления вследствие переедания, ушибы живота и чрезмерная физическая нагрузка. Острое расширение желудка может произойти также после травм, при пневмонии, диабетическом ацидозе или приеме больших доз антихолинергических средств.
Использование после операций пищеводно-желудочного зонда позволяет снизить частоту заворотов.
Наиболее распространенной считается классификация H. Haberer (1912), впоследствии дополненная A. Singleton (1940), в которой выделяют три типа заворота желудка: относительно продольной оси желудка, относительно поперечной оси желудка и смешанный (комбинированный) тип.
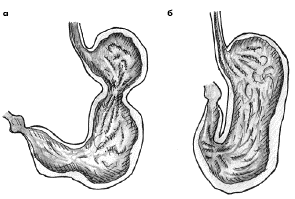
Чаще всего (до 59% случаев) заворот происходит вокруг продольной оси (рис. 1). Данное обстоятельство, вероятнее всего, связано с наличием связочного аппарата двенадцатиперстной кишки и пищеводно-желудочного перехода, которые в известной мере фиксируют данные органы. При этом желудок поворачивается относительно продольной оси — линии, соединяющей кардиальный отдел желудка с привратником, что приводит к непроходимости в пищеводно-желудочном переходе или в пилорическом, кардиальном и антральном отделах желудка. В этом случае поперечно-ободочная кишка перемещается кверху от желудка.
Рис. 1. Механизмы заворота желудка
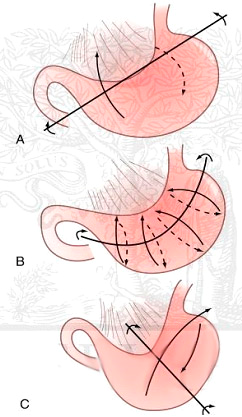
При завороте относительно поперечной оси желудка (39%) поворот органа происходит вокруг линии, соединяющей середину его малой кривизны с серединой большой кривизны желудка. При «слабости» связочного аппарата и/или переполнении желудка содержимым происходит «сближение» привратника и кардиального отдела. Усиление перистальтики при «сближенных» кардиальном и антральном отделах желудка или внезапное повышение внутрибрюшного давления (поднятие тяжести, падение, травма) обычно ведет к развитию заворота. При завороте желудка относительно поперечной оси поперечная ободочная кишка обычно остается книзу от желудка.
Смешанный или комбинированный типы заворота желудка встречаются редко (2%), характеризуются проявлениями обоих механизмов и возникают при завороте желудка относительно поперечной оси органа с вторичной ротацией дна желудка по продольной оси.
Значительная ротация желудка сопровождается максимальным натяжением связочного аппарата, со смещением поперечной ободочной кишки, селезенки, хвоста поджелудочной железы и даже двенадцатиперстной кишки. Заворот желудка может происходить по ходу и против хода часовой стрелки. Чаще наблюдается последний.
По типу течения завороты могут быть полные (на 180°) и частичные, а также острые и хронические, сочетающиеся с грыжей пищеводного отверстия диафрагмы или релаксацией диафрагмы, а также интермиттирующие. По данным Л. Н. Серебриной и Е. Д. Телющенко (1979), в большинстве (70%) случаев завороты желудка носят хронический характер.
При полном завороте желудка полностью закрывается просвет кардиального и пилорического отделов желудка. Частичный заворот желудка у большинства больных наблюдается при диафрагмальной грыже, когда желудок смещается в заднее средостение и характеризуется полуоткрытым просветом кардиального и пилорического отделов желудка.
По этиологии заворот желудка разделяют на два типа: идиопатический и врожденный или приобретенный.
Первый тип встречается у 70% больных и происходит, возможно, из-за «слабости» связочного аппарата желудка, что способствует «сближению» кардии и привратника при наполненном желудке. Этот тип заворота чаще встречается у взрослых.
Второй тип описан у 30% больных и зависит от врожденных или приобретенных отклонений, которые ведут к чрезмерной подвижности желудка. D. Miller и соавт. (1991) описали анатомические дефекты, способствующие развитию этого типа заворота желудка. По мнению разных авторов к ним относятся аномалии развития диафрагмы (43%), аномалии развития связочного аппарата желудка (32%), аспленизм (5%), стеноз привратника (2%), атрезия прямой кишки (1%) и некоторые другие заболевания (например, полиомиелит).
Клиническая картина. Еще в 1904 г. Н. Borchardt предложил триаду признаков, характерную для заворота желудка: безуспешные позывы на рвоту, боли и вздутие в эпигастрии, невозможность введения зонда в желудок. При острых заворотах характерно острое начало заболевания с выраженным болевым синдромом в верхней половине живота, иногда с иррадиацией болей в спину и нижние отделы грудной клетки. При полном завороте желудка отмечаются позывы на рвоту, затем появляется тошнота, мучительная икота, выделение только слюны. При проходимой кардии отмечается многократная рвота без содержимого двенадцатиперстной кишки (без желчи!), не приносящая облегчения.
В клиническом течении заворота желудка следует различать две основные фазы.
Первая фаза — заворот не достиг 180° и не имеется полного закрытия просвета кардиального и пилорического отделов желудка.
Вторая фаза — заворот достигает 180° и наступает полное закрытие просвета кардиального и пилорического отделов желудка.
В начале заболевания брюшная стенка в нижней половине живота остается интактной. Затем живот резко увеличивается в эпигастрии и левом подреберье, где отмечается умеренная болезненность при пальпации. В первые часы после заворота желудка может наблюдаться стул. Состояние больного резко ухудшается во второй фазе заворота (≥180°) с наступлением полного закрытия просвета кардиального и пилорического отделов желудка. При этом болевой синдром резко усиливается, отмечаются выраженный метеоризм и появление перитонеальной симптоматики. При физикальном исследовании над вздутым участком живота определяется высокий тимпанит и исчезают кишечные шумы. При попытке приема жидкости отмечается срыгивание и акт глотания становится невозможным. Характерной особенностью второй фазы заворота является невозможность введения зонда в желудок! При прогрессировании заболевания развиваются одышка, тахикардия, выраженная интоксикация, дистрофические изменения в паренхиматозных органах, тяжелые метаболические нарушения с последующим коллапсом.
При обзорной рентгенографии выявляют резкое растяжение желудка, большой газовый пузырь с множественными горизонтальными уровнями жидкости, а контрастная масса не продвигается далее кардиальной части. Данная триада рентгенологических признаков позволяет поставить диагноз.
Рентгенологическая картина существенно отличается в зависимости от типа заворота желудка: при завороте относительно поперечной оси органа во время рентгенологического исследования в положении больного стоя в желудке определяются два уровня жидкости: один в дне желудка, выявляющийся ниже; другой в теле желудка, находящийся выше. Кроме того, на снимке в вертикальном положении больного часто остается незамеченным так называемый «клюв». Заворот относительно продольной оси диагностировать сложно при отсутствии дефектов диафрагмы. На рентгенограммах удается выявить высокое стояние диафрагмы и наличие большого газового пузыря с горизонтальным уровнем жидкости. При внутригрудном расположении завернувшегося желудка у больного с диафрагмальной грыжей или релаксацией диафрагмы аналогичный газовый пузырь с горизонтальным уровнем жидкости обнаруживают в левой плевральной полости или в заднем средостении на фоне тени сердца.
Острый заворот иногда разрешается спонтанно, но чаще всего требует оперативного лечения, не дожидаясь развития осложнений. При установлении диагноза заворота сразу должна быть проведена декомпрессия желудка. Если установка зонда затруднена или невозможна, следует прекратить попытки в связи с высокой вероятностью перфорации стенки желудка или пищевода, особенно у детей.
При развитии заболевания происходит секвестрация большого объема жидкости в желудке, что сопровождается выраженными электролитными нарушениями (снижением уровня натрия и калия) с последующим развитием гиповолемического шока. К жизненно-опасным осложнениям относят: ущемление желудка в пищеводном отверстии диафрагмы, некроз и перфорацию стенки с последующим развитием перитонита.
Хирургическое лечение острого заворота желудка является основным методом. Однако в литературе описаны единичные наблюдения, когда удавалось добиться успешного устранения заворота с помощью эндоскопической декомпрессии желудка, с последующим длительным шинированием тонким зондом, введенным эндоскопически в двенадцатиперстную кишку.
Хирургическое лечение сводится к расправлению желудка, рассечению спаек. При технических сложностях оправдана предварительная пункция перераздутого отдела желудка с целью предупреждения разрыва переполненного желудка, регургитации и аспирации желудочного содержимого в трахею и бронхи с развитием синдрома Мендельсона. При некрозе стенки желудка показана резекция желудка или гастрэктомия.
Дальнейший ход операции определяется состоянием желудочной стенки, связочного аппарата и состоянием больного. С целью профилактики рецидива заворота желудка некоторые авторы предлагают завершать оперативное вмешательство передней гастропексией, другие — гастростомией, которая не только фиксирует желудок, но и осуществляет его декомпрессию в послеоперационном периоде, а также может быть использована для питания. Кроме того, имеются сведения о хирургическом лечении заворота желудка с помощью лапароскопических технологий. Первое подобное сообщение было сделано M. Eckhauser и J. Ferron в 1985 г., которые выполнили при завороте желудка двойную чрескожную эндоскопическую гастростомию. Кроме того, имеется сообщение K. Koger и J. Stone (1993), которые при остром завороте желудка у больного с параэзофагеальной грыжей выполнили лапароскопическую деторсию желудка, частичное ушивание пищеводного отверстия диафрагмы в сочетании с чрескожной эндоскопической гастростомией, а L. Donier, A. Damamme J. Grataloup (1994) отдают предпочтение эндоскопической гастропексии. Однако имеется и альтернативное мнение, так, по мнению Б. Я. Горина и Р. С. Зейналова (1974), гастростомия сама по себе может стать причиной заворота желудка, а кроме того, эти вмешательства не устраняют предрасполагающих факторов заболевания (Gonzalez-Calvin J. еt al., 1980).
Так, N. Tanner в 1947 г. выполнил при завороте желудка гастропексию с поддиафрагмальной транспозицией толстой кишки. С этой целью производилась мобилизация желудка вдоль большой кривизны, мобилизованная поперечная ободочная кишка и большой сальник перемещались в левое поддиафрагмальное пространство и там фиксировались, а малая кривизна желудка подшивалась к свободному краю печени и круглой связке. Автор исходил из того, что завороту желудка способствует пространственное несоответствия в брюшной полости, а после транспозиции толстой кишки устраняется присасывающая сила поддиафрагмального пространства и прямая тяга за большую кривизну желудка. К 1968 г. N. Tanner оперировал 15 больных по предложенной методике с благоприятным результатом.
По данным различных авторов, при остром завороте желудка летальность варьирует от 30 до 50%. Если острый заворот желудка осложняется некрозом и перфорацией стенки, летальность достигает 60%.
Врожденные заболевания: Аномалии развития
УДВОЕНИЕ ЖЕЛУДКА
Это одна из самых редких патологий желудка. Впервые оперативное вмешательство при дупликатуре желудка осуществил Вендель в 1911 г., однако сам термин «удвоение желудка» был предложен только в 1937 г. W. Ladd. Удвоение желудка характеризуется наличием изолированного (85%) или сообщающегося (15%) с желудком или двенадцатиперстной кишкой полого образования с типичной локализацией по большой кривизне (75%) или задней поверхности желудка (25%). Следует отметить, что локализация гастродуоденальных удвоений может быть самой разнообразной и при превышении объема дупликатуры размеров самого желудка дупликации могут проникать через пищеводное отверстие диафрагмы в средостение или же в плевральную полость, образуя свищи с близлежащими органами.
Удвоения желудка являются редкой патологией и составляют 3,8% всех желудочно-кишечных удвоений. На сегодняшний день в мировой литературе описано всего 130 наблюдений.
Дупликатуры желудка могут быть нескольких видов. Чаще всего выделяют четыре варианта удвоения:
1) кистозное;
2) кистозное с проникновением части желудка через пищеводное отверстие диафрагмы в грудную полость;
3) дивертикулярное;
4) наличие дополнительного желудка, который чаще сообщается с основным.
Отдельные авторы выделяют цилиндрическую и кистозную формы удвоения. Причем подчеркивают, что оба типа кист могут как сообщаться с просветом желудка, так и не иметь с ним сообщения. Ряд ученых различают кистозный, дивертикулярный и тубулярный типы удвоения органа. Кистозное удвоение желудка встречается наиболее часто и составляет 80% случаев.
Кроме того, существуют критерии удвоения желудка, предложенные К. У. Ашкрафтом и Т. М. Холдером ( 1996):
внутренняя выстилка эпителием пищеварительного тракта;
наличие наружного гладкомышечного слоя;
кровоснабжение от желудочных сосудов;
связь с желудком — киста является как бы его продолжением.
Клиническая картина зависит от размеров образования, активности слизистой оболочки и степени сообщения с желудком и другими органами. При неосложненном течении пациенты отмечают срыгивание, рвоту, боли или неприятные ощущения в эпигастральной области. При осложненном течении наблюдается изъязвление в добавочной полости с признаками рецидивирующего кровотечения или перфорации. Среди других проявлений необходимо помнить о возможности развития пневмонии при перемещении части кисты в грудную полость и панкреатита, обусловленного наличием свища между образованием и поджелудочной железой. Наиболее трудно установить диагноз удвоения желудка у пациентов с основным проявлением заболевания в виде анорексии, болевого синдрома и анемии, а также в случаях развития рака в дупликации желудка (Lewis Р., 1961).
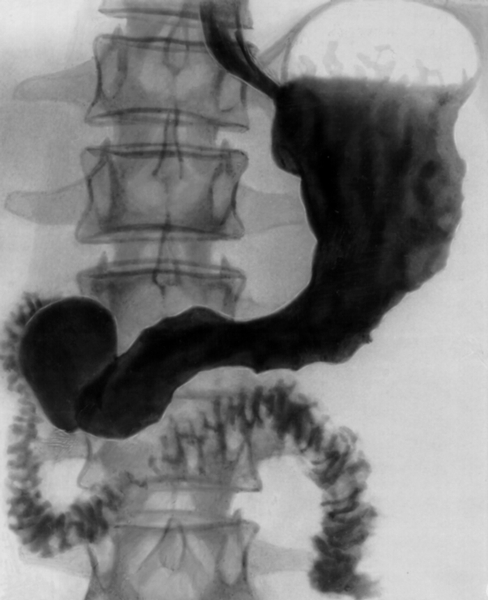
В литературе описан случай «зеркального» удвоения желудка, диагностированного при рентгеноконтрастном исследовании, которое было выполнено для исключения язвы, в связи с частыми эпизодами желудочно-кишечных кровотечений. При рентгеновском исследовании (рис. 2) было выявлено «зеркальное» удвоение желудка, которое законтрастировалось ретроградно из двенадцатиперстной кишки через второй пилорический канал. При оперативном вмешательстве был удален удвоенный желудок длиной 48 см, в котором определялись множественные кровоточащие язвы (Bockus H. L., 1963).
Рис. 2. Рентгенограмма «зеркального» удвоения желудка
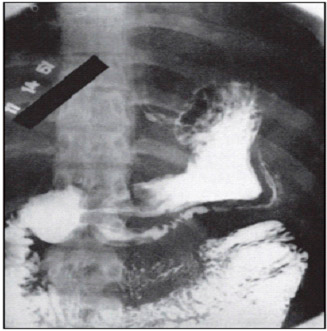
Диагностика основывается на рентгенологическом, эндоскопическом и эндосонографическом исследованиях. При рентгенологическом исследовании определяется наличие добавочной полости, сообщающейся с желудком, и наблюдается дополнительный уровень выше или ниже газового пузыря желудка, чаще по большой кривизне. Если полость не сообщается с желудком, отмечается деформация контуров на соответствующем участке желудка.
Оперативное лечение заключается в удалении дупликации без вскрытия просвета органа. Если это технически невозможно, формируют широкий анастомоз между образованием и желудком.
Врожденные заболевания: Аномалии развития
ДИВЕРТИКУЛЫ ЖЕЛУДКА
Это редко встречающиеся образования с типичной локализацией непосредственно под кардией на задней стенке желудка, у его малой кривизны (до 80%). Значительно реже дивертикулы локализуются по большой кривизне (8%), в антральном отделе желудка (10%), а также на передней стенке тела и по малой кривизне в области средней и нижней третей желудка (2%). В некоторых случаях дивертикулы одновременно обнаруживаются в двенадцатиперстной и толстой кишках (редко и в тонкой). Дивертикулы желудка редко проявляются клинически.
При дивертикулах больших размеров могут наблюдаться такие осложнения, как выраженный болевой синдром, кровотечение и перфорация.
Диагностика: рентгенологическое обследование, фиброэзофагогастродуоденоскопия (ФЭГДС) (рис. 3).
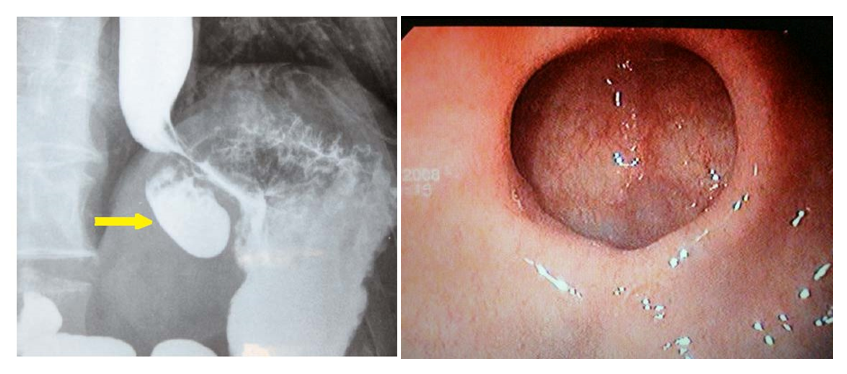 Рис. 3. Рентгенограмма и эндоскопическая картина дивертикула желудка
Рис. 3. Рентгенограмма и эндоскопическая картина дивертикула желудка
Операция показана только при наличии осложнений. Объем оперативного вмешательства заключается в резекции дивертикула. Следует отметить, что выделение дивертикула при локализации по задней стенке субкардиального отдела желудка возможно только левосторонним трансторакальным доступом.
Врожденные заболевания: Аномалии развития
КИСТЫ ЖЕЛУДКА
Это групповое обозначение патологических изменений в желудке. Выделяют две основные форм кист.
Кисты, как дефект развития желудка, являются следствием удвоения (дупликатуры) желудка и, как правило, локализуются по большой кривизне желудка или в области привратника и крайне редко сообщаются с просветом органа. При расположении кист в области выходного отдела желудка типичным осложнением является обструкция. В желудке эта патология встречается еще реже, чем в пищеводе и тонкой кишке. Чаще заболевание встречается в педиатрической практике, однако подобные находки могут встречаться и у взрослых лиц.
При эндоскопическом исследовании необходимо проводить дифференциальную диагностику между кистами и опухолью желудка. Просвет кисты обычно ограничен слизистой оболочкой желудочного или кишечного типа, в которой может развиться хроническая язва. В стенке кист иногда обнаруживаются эктопические комплексы ткани поджелудочной железы.
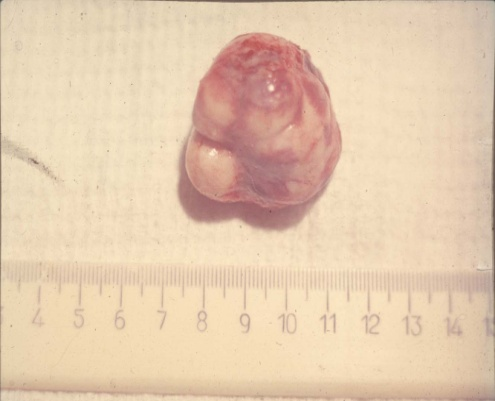
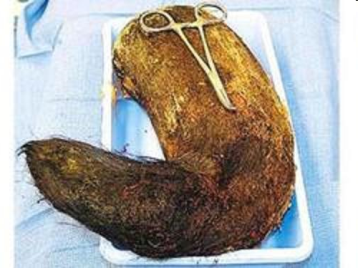
Кисты желудка могут достигать довольно больших размеров. Так, египетские хирурги удалили из желудка 17-летней девушки кисту, вес которой составлял 45 кг: «Огромная неоднородная масса заняла все пространство от почек до диафрагмы. Понятно, что киста давила на все внутренние органы пациентки, вызывая сердечную недостаточность, боли и затрудненное дыхание» (рис. 4).


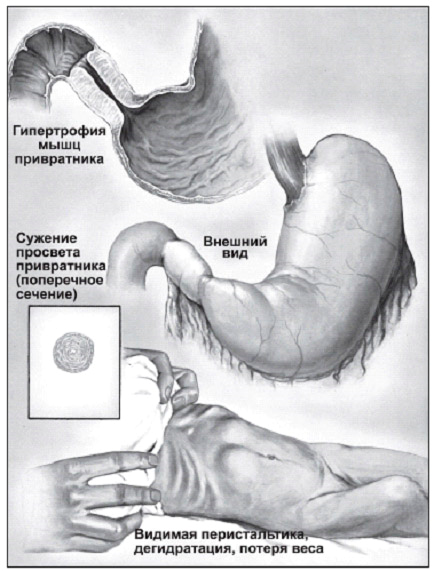 Рис. 5. Гипертрофический пилорический стеноз у взрослых
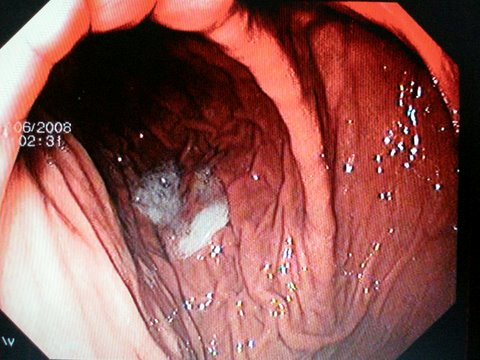
Рис. 5. Гипертрофический пилорический стеноз у взрослых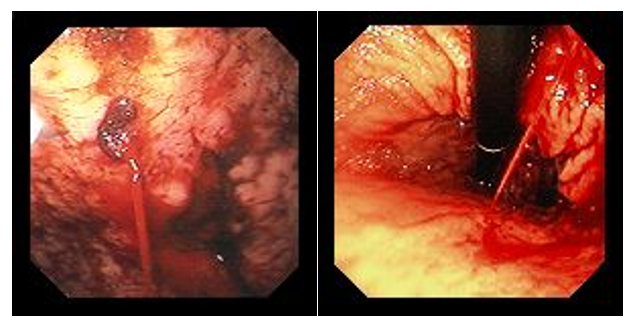 Рис. 6. Эндоскопическая картина синдрома Дьелафуа
Рис. 6. Эндоскопическая картина синдрома Дьелафуа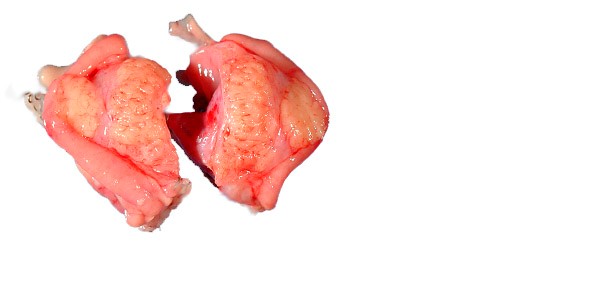 Рис. 7. Гетеротопированные фрагменты желудка
Рис. 7. Гетеротопированные фрагменты желудка Рис. 8. Болезнь Menetrier
Рис. 8. Болезнь Menetrier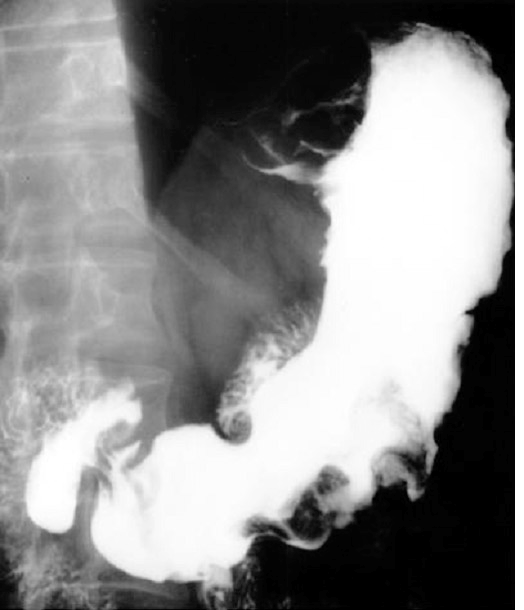
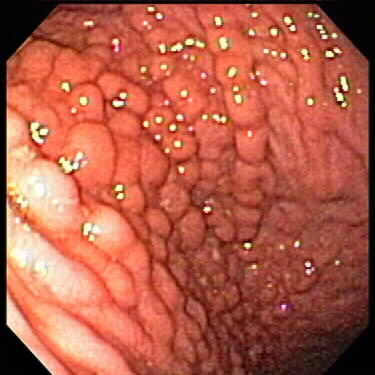
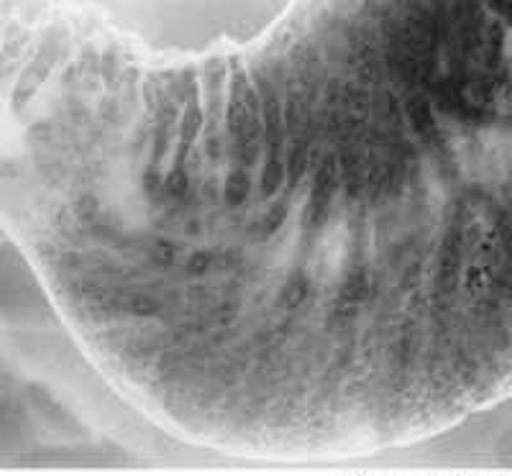
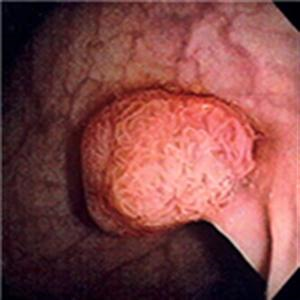
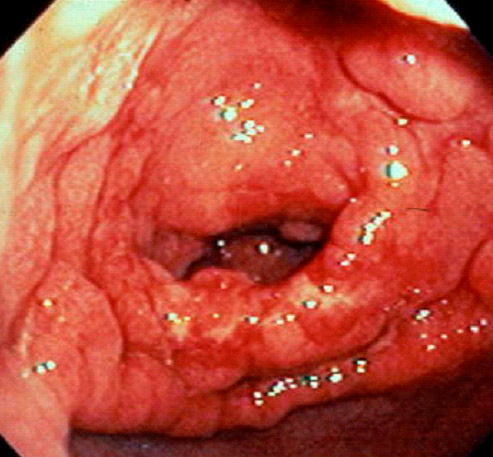 Рис. 13. Эндоскопическая картина сифилиса желудка
Рис. 13. Эндоскопическая картина сифилиса желудка Рис. 14. Возбудитель р. Anisakis
Рис. 14. Возбудитель р. Anisakis