Синдром верхней брыжеечной артерии или артерио-мезентериальная компрессия двенадцатиперстной кишки является редким заболеванием, обусловленным сдавлением горизонтальной ветви двенадцатиперстной кишки верхней брыжеечной артерией, вследствие чего развивается хроническое нарушение дуоденальной проходимости. Неминуемость развития вторичного хронического нарушения дуоденальной проходимости, на фоне длительно существующего синдрома артерио-мезентериальной компрессии двенадцатиперстной кишки, что, в свою очередь, приводит к существенным нутритивным и психосоматическим изменениям, диктует необходимость проведения оперативного лечения.
Синдром верхней брыжеечной артерии или артерио-мезентериальная компрессия двенадцатиперстной кишки является редким заболеванием, обусловленным сдавлением горизонтальной ветви двенадцатиперстной кишки (ДПК) верхней брыжеечной артерией (ВБА), вследствие чего развивается хроническое нарушение дуоденальной проходимости [1, 10]. Впервые это патологическое состояние было описано в 1842 году австрийским патологоанатомом профессором Carl Freiherr von Rokitansky, а более детально синдром был изучен D.P. Wilkie, который в 1927 году обобщил собственный опыт лечения 75 пациентов [1, 2]. По различным литературным данным, артерио-мезентериальная компрессия двенадцатиперстной кишки приводит к развитию хронического нарушения дуоденальной проходимости (ХНДП) в 3,0−17,0 % случаях, хотя диагностируется лишь в 0,3% наблюдений, а летальность может достигать 33,0% [1, 3, 7].
В основе механизма развития заболевания лежит компрессия горизонтальной ветви ДПК между абдоминальным отделом аорты и отходящей от него под острым углом верхней брыжеечной артерией. Нередко к этому приводит недостаточное количество жировой ткани брыжейки и забрюшинного пространства, выполняющее каркасную функцию верхне-мезентериальных сосудов, что встречается, как правило, у астеников. В норме угол отхождения ВБА от аорты колеблется от 38 до 60 градусов [4]. В случаях, когда угол отхождения ВБА от аорты составляет менее 28 градусов, правомочно говорить о сосудистом генезе ХНДП [2, 8]. Кроме того, данное состояние может быть вызвано аномальным развитием артерии, наличием дополнительных сосудов, выраженным лордозом, висцероптозом, нередко возникающим после значительной потери веса, слабостью мышц передней брюшной стенки, оперативным лечением деформирующих заболеваний позвоночника, а также высоким отхождением или короткой по длине связкой Трейтца [2, 3]. Всё это вызывает риск развития непроходимости сдавленного участка ДПК, с последующим развитием грубых органических изменений. Клиническое проявление ХНДП компрессионного генеза заключается в чувстве быстрого насыщения, ощущении тяжести в эпигастрии, тошноте, болевом синдроме в верхних отделах живота, постоянной рвоте, вследствие чего у пациентов формируется страх перед приемом пищи, что в свою очередь приводит к нарушению пищевого поведения вплоть до анорексии [5, 6, 9, 10].
Приводим собственное клиническое наблюдение.
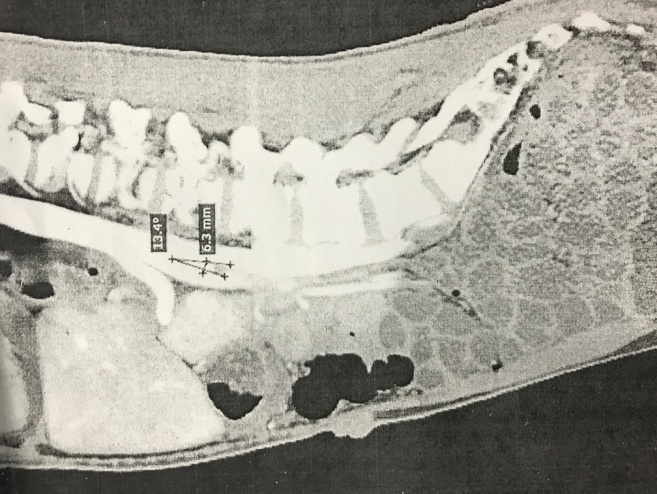
Пациент К., 25 лет обратился в клинику факультетской хирургии им. И.И. Грекова СЗГМУ им. И.И.Мечникова 29.11.2016 г. с жалобами на боли в эпигастральной области и левом подреберье, чувство тошноты, рвоту после каждого приема пищи, независимо от ее объема и характера, общую слабость и потерю веса на 15 кг в течении года. Из анамнеза заболевания выяснилось, что с 2011 года пациент стал отмечать наличие тошноты, рвоты, чувство тяжести в эпигастрии после приема пищи, в последующий год наблюдалось прогрессивное снижение массы тела (в 2012 г. m~65 кг.). Неоднократно обследовался, проходил лечение в различных клиниках . Так, по данным рентгенографии желудочно-кишечного тракта с контролем пассажа бариевой взвеси от 2014 г. отмечалось снижение моторно-эвакуаторной функции желудка, ДПК, висцероптоз (увеличенный в размерах желудок, ДПК, петли тонкой кишки на уровне малого таза). Кроме того, отмечалось замедление в эвакуации контраста из желудка и ДПК в дистальном направлении в течение 2 часов. После дополнительного обследования (данные пациентом не предоставлены) был установлен диагноз «стеноз чревного ствола», в связи с чем 03.02.2015 г. была выполнена: «Лапаротомия. Фундопликация по Ниссену. Декомпрессия чревного ствола». После операции пациент почувствовал улучшение общего состояния: отметил увеличение массы тела на 3 кг; прекратились тошнота и рвота после приема пищи. Однако через 2 месяца после оперативного лечения симптомы полностью возобновились. Больной находился под наблюдением гастроэнтеролога, получал консервативную терапию без существенного эффекта. При очередном обследовании, согласно данным рентгенографии с контрастированием желудочно-кишечного тракта от 08.11.2016 г., сохраняется замедленная эвакуация из желудка, ДПК, выраженный гастроптоз и дуоденоптоз. При этом эвакуация из пищевода в желудок составляет порядка 30сек., из желудка в ДПК около 1-2 мин, а эвакуация из ДПК до Трейтца 30-40 сек. Признаки спланхноптоза. По данным спиральной компьютерной томографии (СКТ) органов брюшной полости с контрастированием от 18.07.2016 г., отмечается дилатация нисходящей и горизонтальной части ДПК. Угол отхождения ВБА от аорты составляет 13,4 градусов (Рис 1).
Рис.1. СКТ- картина органов брюшной полости с контрастированием (стрелками указан угол отхождения ВБА от аорты)
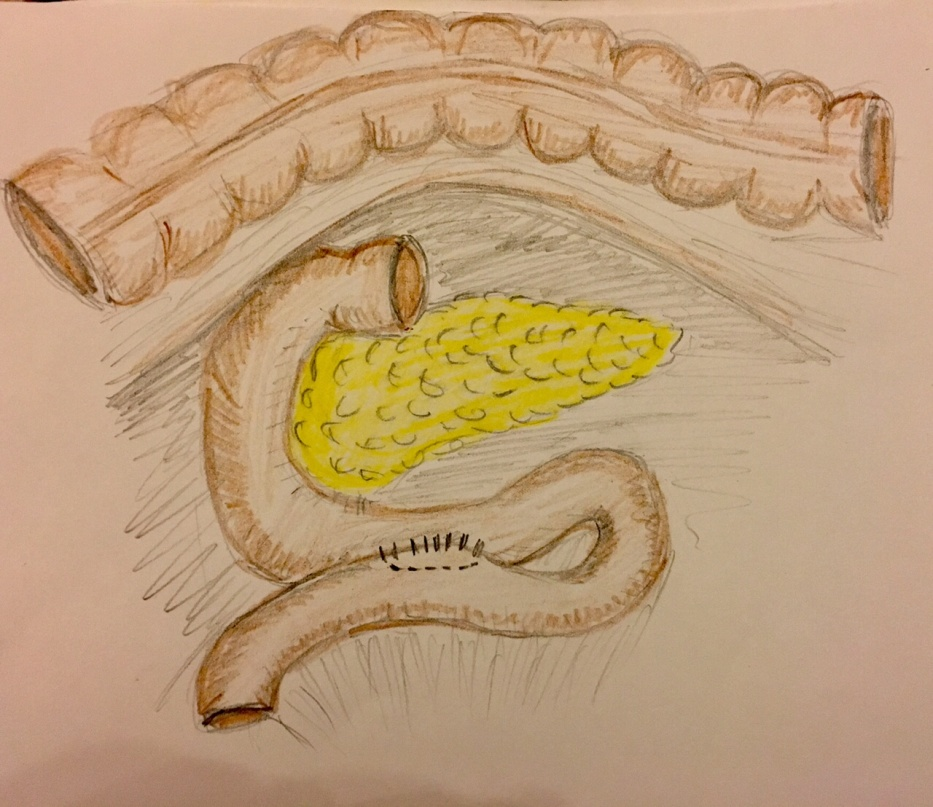
При поступлении в клинику у пациента отмечался дефицит массы тела (ИМТ 17), выраженный нутритивный дефицит. Учитывая анамнез, а также лабораторно-инструментальные, данные был сформулирован диагноз: «Артерио-мезентериальная компрессия ДПК. Хроническое нарушение дуоденальной проходимости в стадии субкомпенсации. Белково-энергетическая недостаточность» и выставлены показания к оперативному лечению. Была проведена полноценная предоперационная подготовка, направленная на коррекцию нутритивных и водно-электролитных нарушений. Кроме того, за связку Трейтца был эндоскопически установлен назоинтестинальный зонд для осуществления энтерального питания. В последующем пациенту выполнено оперативное лечение в объеме: «Лапаротомия. Адгезиолизис. Операция Стронга. Операция Альбрехта-Стейвели в модификации Боппа. Дренирование брюшной полости» (19.12.2016 ). При ревизии в верхнем этаже брюшной полости обнаружен выраженный спаечный процесс с деформацией желудка. Выполнен адгезиолизис острым путем с восстановлением нормального расположения желудка. Отмечается дилятация двенадцатиперстной кишки до 6-8 см в диаметре проксимальнее места артерио-мезентериальной компрессии,а дистальнее – диаметр двенадцатиперстной кишки порядка 3 см. Выполнена операция Стронга. Позадиободочно сформирован анастомоз по типу “бок в бок” между горизонтальной частью двенадцатиперстной кишки и тощей кишкой на короткой петле двухрядными узловыми швами. При этом предварительно было установлено два зонда − декомпрессионный “толстый” в проксимальную часть ДПК и желудок, а “тонкий” зонд для энтерального питания проведен за анастомоз.
Рис. 2. Дуоденоеюностомии по Albrecht Stavely в модификации Boppe
Послеоперационный период протекал без осложнений. Зонды удалены на 7 сутки. Пациент переведен на частое (5-6 раз в сутки) дробное питание. Клинических признаков нарушения проходимости пассажа пищевого химуса не отмечалось. Выписан на 14 сутки послеоперационного периода в удовлетворительном состоянии. В настоящее время практически здоров.
В заключение хотелось бы отметить, что в подобных случаях мы отдаем предпочтение операции Robinson в связи с хорошими отдаленными функциональными результатами. Однако в данном случае, учитывая выраженные водно-электролитные нарушения и белково-энергетическую недостаточность, было отдано предпочтение менее сложному с технической точки зрения оперативному вмешательству [9], а именно дуоденоеюностомии по Albrecht Stavely в модификации Boppe.
Приведенный клинический случай демонстрирует сложности ранней диагностики артерио-мезентериальной компрессии двенадцатиперстной кишки. Неминуемость развития вторичного хронического нарушения дуоденальной проходимости на фоне длительно существующего синдрома артерио-мезентериальной компрессии двенадцатиперстной кишки, что, в свою очередь, приводит к существенным нутритивным и психосоматическим изменениям, диктует необходимость проведения оперативного лечения, оптимальным вариантом которого является формирование дуоденоеюноанастомоза.
Список литературы
- Welsch T. – Recalling superior mesenteric artery syndrome / T. Welsch, M.W. Büchler, P.Kienle// Digestive Surgery, 2007.- P. 149–156
- Lee T.H. – Superior mesenteric artery syndrome: where do we stand today?/ T.H. Lee [et al.]// Journal of gastrointestinal Surgery, 2012. – P. 2203–2211
- Zaraket V. – Wilke’s syndrome or superior mesenteric artery syndrome: fact or fantasy/ V. Zaraket, L. Deeb//Case Reports in Gastroenterology,2015. –P. 194–199
- Ozkurt H. – Measurement of the distance and angle between the aorta and superior mesenteric artery: normal values in different BMI categories/ H. Ozkurt [et al.] // Surgical and Radiologic Anatomy, 2007.- vol. 29, no. 7.- P. 595–599
- Fong J.K. – Imaging findings and clinical features of abdominal vascular compression syndromes / Fong J.K. [et al.] // American Journal of Roentgenolgy.-2014. – P. 29–36
- Gebhart T. – Superior mesenteric artery syndrome/ T. Gebhart // Gastroenterology Nursing -2015.- P. 189–193
- Capitano S. – Superior mesenteric artery syndrome—believe in it! Report of a Case / S. Capitano, G. Donatelli, G. Boccoli// Case Reports in Surgery, 2012.- 282646
- Arthurs O.J. – Nutcracker and SMA syndromes: what is the normal SMA angle in children?/ O.J. Arthurs, U. Mehta, P.A. Set/ European journal of radiology, 2012. – P. 854–861
- Репин В.Н. – Артериомезентериальная компрессия двенадцатиперстной кишки / В.Н. Репин, М.В. Репин, Н.С. Ефимов. – Пермь : Медицина, 2009. – 232 с.
- Кондрашин В.Н. – Редкий случай диагностики артериомезентериальной компрессии двенадцатиперстной кишки в эндоскопической практике /
В.Н. Кондрашин, Р.Х. Дин // Здравоохранение Дальнего Востока. – 2013. – №2. – С. 40-41.